如图所示,若电解5 min 时铜电极质量增加2.16 g,试讨论:
时铜电极质量增加2.16 g,试讨论: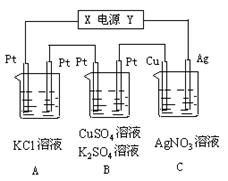
⑴电源电极X名称为_________。
⑵ pH变化:A_______,B______,C______。
⑶通过5 min时,B中共收集224 mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为______________。
⑷若A中KCl溶液的体积也是2 00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________
00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________ 。
。
如图所示,若电解5 min 时铜电极质量增加2.16 g,试讨论:
时铜电极质量增加2.16 g,试讨论:
⑴电源电极X名称为_________。
⑵ pH变化:A_______,B______,C______。
⑶通过5 min时,B中共收集224 mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为______________。
⑷若A中KCl溶液的体积也是2 00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________
00 mL,且电解过程中体积不变,电解后溶液中的氢氧根离子浓度是__________ 。
。