将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/ L的NaO
L的NaO H溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求:
H溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求: 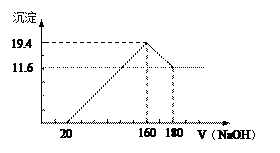
(1)生成沉淀达到最大时消耗NaOH的物质的量___________mol
(2)合金中Mg的质量________ g
g
(3)所用HCl的物质的量浓度为__________。
将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/ L的NaO
L的NaO H溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求:
H溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求: 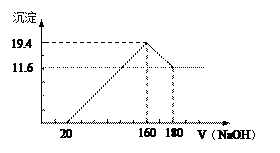
(1)生成沉淀达到最大时消耗NaOH的物质的量___________mol
(2)合金中Mg的质量________ g
g
(3)所用HCl的物质的量浓度为__________。