运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
 (1)合成氨反应反应
(1)合成氨反应反应
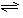 ,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。
,若在恒温、恒压条件下向平衡体系中通入氩气,平衡移动(填"向左""向右"或"不");,使用催化剂反应的
(填"增大""减小"或"不改变")。
 (2)
(2)
 则反应
的
=
。
则反应
的
=
。
 (3)在25℃下,向浓度均为0.1
的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
(3)在25℃下,向浓度均为0.1
的
和
混合溶液中逐滴加入氨水,先生成沉淀(填化学式),生成该沉淀的离子方程式为。已知25℃时
=1.8×10-11,
=2.2×10-20。
 (4)在25℃下,将
的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。
(4)在25℃下,将
的氨水与0.01
的盐酸等体积混合,反应平衡时溶液
则溶液显性(填"酸""碱"或"中");用含
的代数式表示
的电离常数
=。