下图是某市污水处理的工艺流程示意图: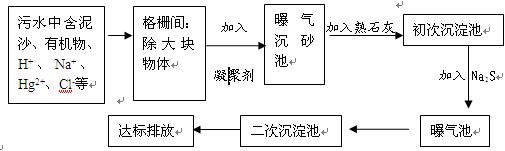
(1)常用的凝聚剂可以是 (任填一种凝聚剂的名称)
(2)加入熟石灰的目的是 ,写出相关的化学方程式 。
(3)加入Na2S的作用是 。
下图是某市污水处理的工艺流程示意图:
(1)常用的凝聚剂可以是 (任填一种凝聚剂的名称)
(2)加入熟石灰的目的是 ,写出相关的化学方程式 。
(3)加入Na2S的作用是 。