(1)用于金属焊接的某种焊条,其药皮由大理石(CaCO3)、水泥、硅、铁等配制而成。
①Al的原子结构示意图为_____________________;
②30Si的原子的中子数为_________;
③可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
除去石灰水中悬浮的大理 石颗粒 。
石颗粒 。
(2).根据下图所示,并选择适宜的物质可以完成图中各步转化推断物质X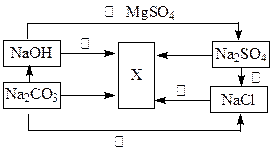
则X的化学式: 。
(1)用于金属焊接的某种焊条,其药皮由大理石(CaCO3)、水泥、硅、铁等配制而成。
①Al的原子结构示意图为_____________________;
②30Si的原子的中子数为_________;
③可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
除去石灰水中悬浮的大理 石颗粒 。
石颗粒 。
(2).根据下图所示,并选择适宜的物质可以完成图中各步转化推断物质X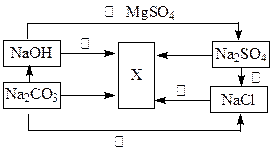
则X的化学式: 。