为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
【探究一】
(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是 ▲
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认 为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选
为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选 用 ▲ (选填序号)。
用 ▲ (选填序号)。
a.KSCN溶液和氯水  b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生反应:
SO2+Br2+2H2O===2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数为 ▲ 。
【探究二】
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893g·L-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。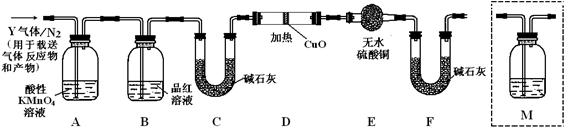
(3)装置B中试剂的作用是 ▲
(4)分析Y气体中的Q2气体是如何生成的 ▲ (用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于 ▲ (选填序号)。
a.A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有Q1,预计实验现象应是 ▲
 H+ + OH-、HCO3-
H+ + OH-、HCO3-

 粤公网安备 44130202000953号
粤公网安备 44130202000953号