(10分)下图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.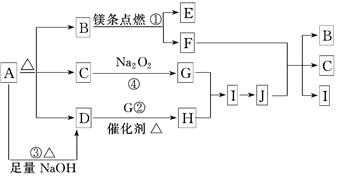
请填写以下空白:
(1)A的化学式____________
(2)写出反应①②的化学方程式:
①______________________,②______________________.
(3)写出反应③的离子方程式:_______________________.
(4)在反应④中,当生成标准 状况下2.24 L G时,转移电子数为________ mol.
状况下2.24 L G时,转移电子数为________ mol.
(10分)下图中A~J分别代表相关反应的一种物质.已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出.
请填写以下空白:
(1)A的化学式____________
(2)写出反应①②的化学方程式:
①______________________,②______________________.
(3)写出反应③的离子方程式:_______________________.
(4)在反应④中,当生成标准 状况下2.24 L G时,转移电子数为________ mol.
状况下2.24 L G时,转移电子数为________ mol.