利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的"联合制碱法"是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%。其原理流程如下图所示:
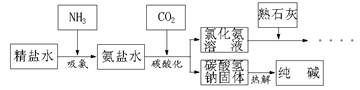
(1)氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水)。氨盐水比食盐水更容易吸收二氧化碳,其原因是;
(2)写出氯化铵溶液与熟石灰反应的化学方程式。
利用井盐和合成氨生产的氨气及二氧化碳生产纯碱的"联合制碱法"是由我国著名化学家侯德傍先生发明的,其氯化钠的利用率高达96%。其原理流程如下图所示:

(1)氨极易溶于水,向饱和食盐水通入氨气可得到饱和食盐水和氨水的混合盐水(称为氨盐水)。氨盐水比食盐水更容易吸收二氧化碳,其原因是;
(2)写出氯化铵溶液与熟石灰反应的化学方程式。