如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题: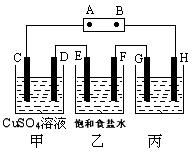
(1)电源的A极是_______;
(2)写出甲装置中电解反应的总方程式:_____ ____;
(3)如果收集乙装置中产生的气体,EF两电极产生的气体的体积比是______________;
(4)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式)。
如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞液,在F极附近显红色。试回答以下问题:
(1)电源的A极是_______;
(2)写出甲装置中电解反应的总方程式:_____ ____;
(3)如果收集乙装置中产生的气体,EF两电极产生的气体的体积比是______________;
(4)欲用丙装置给铜镀银,G应该是_______,电镀液的主要成分是_________(填化学式)。