2014年莱芜共出现284天雾霾天气,其中重度霾15天。燃煤和汽车尾气是造成空气污染的原因之一。
I.已知:①CaO(s)+CO2(g)=CaCO3(s) ΔH=-178.3 kJ/mol
②CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ/mol
③2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8 kJ/mol
写出CaCO3与SO2反应生成CaSO4的热化学方程式:____
II.(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)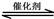 2CO2(g)+ N2(g),△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
2CO2(g)+ N2(g),△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。

(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
时间/min |
NO
|
N2
|
CO2
|
0
|
1.00
|
0
|
0
|
10
|
0.58
|
0.21
|
0.21
|
20
|
0.40
|
0.30
|
0.30
|
30
|
0.40
|
0.30
|
0.30
|
40
|
0.32
|
0.34
|
0.17
|
50
|
0.32
|
0.34
|
0.17
|
①10min~20min以v(CO2) 表示的平均反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变
B.2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变
D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。
III.化学在环境保护中起着十分重要的作用,利用电化学降解法可用于治理水中硝酸盐的污染。该方法可用H2将NO3-还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。其原理如下图所示。
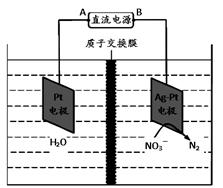
电源负极为 (填A或B),阴极反应式为 ;若电解过程中转移了2mol电子,则质子交换膜左侧极室电解液的质量减少 克。
 ___
___ ________________________
________________________
 ___
___ ________________________
________________________