认真观察A、B两装置图,并填空。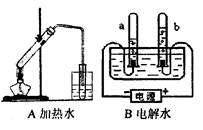
(1)写出B装置中发生反应的符号表达式: ▲ ;在该反应中的能量转化形式是 ▲ 能转化为 ▲ 能;B装置中气体收集方法属于 ▲ ;
(2)a试管与b试管收集到的气体体积之比约为 ▲ ,a试管中的气体在空气中燃烧的现象是 ▲ :检验b试管中的气体常用的方法是 ▲ 。
(3)用分子和原子的观点分析比较A装置和B装置在实验过程中水的变化情况: ▲ 。
认真观察A、B两装置图,并填空。
(1)写出B装置中发生反应的符号表达式: ▲ ;在该反应中的能量转化形式是 ▲ 能转化为 ▲ 能;B装置中气体收集方法属于 ▲ ;
(2)a试管与b试管收集到的气体体积之比约为 ▲ ,a试管中的气体在空气中燃烧的现象是 ▲ :检验b试管中的气体常用的方法是 ▲ 。
(3)用分子和原子的观点分析比较A装置和B装置在实验过程中水的变化情况: ▲ 。