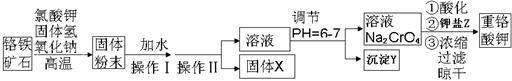
氯化铁是常见的水处 理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(1)试写出吸收塔中反应的离子方程式: 。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是: 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)FeCl3的质量分数通常可用碘量法测定:称取6克无水氯化铁样品,溶于稀盐酸,再转移到250mL容量瓶,用蒸馏水定容;取出25mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1 mol/L Na2S2O3溶液滴定用去V mL。
(已知:2Fe3+ +2I-= I2+2Fe2+ I2+2S2O32-=2I-+S4O62-)
①滴定终点的现象是: 。
②滴定至终点,实验数据如下表所示: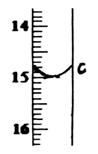
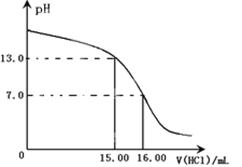
(第一次滴定终点的数据如右图中c点所示,请将你读得的数据填入表中)
| 滴定次数 |
待测液体积(mL) |
滴定前读数(mL) |
滴定后读数(mL) |
| 第一次 |
25.00 |
0.00 |
c= |
| 第二次 |
25.00 |
0.00 |
14.99 |
| 第三次 |
25.00 |
0.00 |
15.01 |
则样品中氯化铁的质量分数为 (写出最终的计算结果)。
③下列操作可能使测定结果偏低的是 。
A.滴定管在注入溶液前用蒸馏水洗后未用标准液润洗
B.开始时碱式滴定管尖嘴部分留有气泡,滴定过程中消失
C.盛FeCl3溶液的锥形瓶滴定前用FeCl3溶液润洗了2次
D.滴定前仰视滴定管读数,滴定后平视滴定管读数


 粤公网安备 44130202000953号
粤公网安备 44130202000953号