亚硝酸钠( NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+
NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+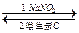 Fe3+
Fe3+
(1)转化1中,氧化剂是 ,还原剂是 。
(2)转化2中,Fe3+作 剂,维生素C表现 性。
亚硝酸钠( NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+
NaNO2)外观酷似食盐,但它是一种有毒的物质。误食亚硝酸钠会使人体血液中的Fe2+转化为Fe3+而引起中毒,服用维生素C可使Fe3+转化为Fe2+,从而达到解毒的目的。转化过程可表示为:Fe2+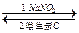 Fe3+
Fe3+
(1)转化1中,氧化剂是 ,还原剂是 。
(2)转化2中,Fe3+作 剂,维生素C表现 性。