五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。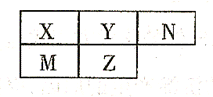
请回答下列问题:
(1)元素X位于周期表中第 周期, 族;
(2)这些元素的氢化物中,稳定性最强的是 (写化学式);
(3)Y与N形成的化合物中,Y可能的化合价有 ;
(4)M、Z的原子半径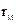
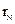 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
五种短周期元素在周期表中的相对位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
请回答下列问题:
(1)元素X位于周期表中第 周期, 族;
(2)这些元素的氢化物中,稳定性最强的是 (写化学式);
(3)Y与N形成的化合物中,Y可能的化合价有 ;
(4)M、Z的原子半径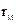
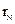 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。