下图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极。工作时M、N两个电极的质量都不减少,则下列说法正确的是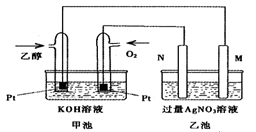
| A.M电极的材料是石墨 |
| B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448ml |
| C.在此过程中,甲池中OH-向通乙醇的一极移动 |
| D.在此过程中,乙池溶液中电子从M电极向N电极移动[ |
下图是一个乙醇燃料电池常温工作原理示意图,乙池中的两个电极一个是石墨电极,一个是铁电极。工作时M、N两个电极的质量都不减少,则下列说法正确的是
| A.M电极的材料是石墨 |
| B.若乙池中某一电极质量增加4.32g时,理论上消耗氧气为448ml |
| C.在此过程中,甲池中OH-向通乙醇的一极移动 |
| D.在此过程中,乙池溶液中电子从M电极向N电极移动[ |