请解决以下有关物质分类的问题:
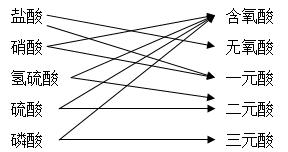
(1)将几种酸按下列分类的方法进行分类,其分类方法的名称叫 ,其中有一处错误是  。
。
(2)下列物质:①Na ②Br2 ③Na2O ④NH3 ⑤CO2 ⑥蔗糖 ⑦NaCl ⑧稀盐酸 ⑨H2SO4⑩Ba(OH)2 属于电解质的是 (用序号填写)。
请解决以下有关物质分类的问题:
(1)将几种酸按下列分类的方法进行分类,其分类方法的名称叫 ,其中有一处错误是  。
。
(2)下列物质:①Na ②Br2 ③Na2O ④NH3 ⑤CO2 ⑥蔗糖 ⑦NaCl ⑧稀盐酸 ⑨H2SO4⑩Ba(OH)2 属于电解质的是 (用序号填写)。