 实验
实验 室用下图装置制取少量溴苯,填写下列空白
室用下图装置制取少量溴苯,填写下列空白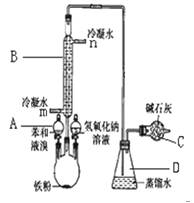
(1).写出仪器A的名称 ;B的名称 ; (2).请你写出实验室制取溴苯的化学方程式 ;
(2).请你写出实验室制取溴苯的化学方程式 ;
(3).长导管的下口为什么不插入锥形瓶的液面下
(4).反应完后,向烧瓶中加NaOH  溶液的作用是:
溶液的作用是:
(5).冷凝水的进水口是(填m或n) ,
 实验
实验 室用下图装置制取少量溴苯,填写下列空白
室用下图装置制取少量溴苯,填写下列空白
(1).写出仪器A的名称 ;B的名称 ; (2).请你写出实验室制取溴苯的化学方程式 ;
(2).请你写出实验室制取溴苯的化学方程式 ;
(3).长导管的下口为什么不插入锥形瓶的液面下
(4).反应完后,向烧瓶中加NaOH  溶液的作用是:
溶液的作用是:
(5).冷凝水的进水口是(填m或n) ,