邻羟基苯甲酸的结构式为 ,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:
,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸: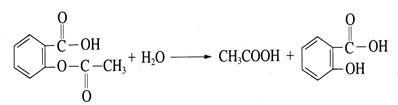
据此,请回答:
这个反应的反应类型为 ;
有时,生 产厂家将乙酰水杨酸制成其钠盐或钙盐,目的是
产厂家将乙酰水杨酸制成其钠盐或钙盐,目的是 
。
邻羟基苯甲酸的结构式为 ,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:
,俗名为水杨酸,在医学上具有解热镇痛和抗炎、抗风湿作用,由于它具有酸性而刺激胃肠道产生严重的反应,因此通常将它先转化为乙酰水杨酸(阿司匹林),服用后在人体内会缓慢反应生成水杨酸:
据此,请回答:
这个反应的反应类型为 ;
有时,生 产厂家将乙酰水杨酸制成其钠盐或钙盐,目的是
产厂家将乙酰水杨酸制成其钠盐或钙盐,目的是 
。