实验室用下列方法测定某水样中O2的含量。
(1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为 。
实验步骤:
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是 。
②用注射器抽取20.00 mL 某水样从A 处注入锥形瓶。
③再分别从A 处注入含m mol NaOH的溶液及过量的MnSO4 溶液。
④关闭止水夹a、b,将锥形瓶中溶液充分振荡;
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:
MnO(OH)2+2I-+4H+==Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液及含n mol H2SO4硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应方程式为:I2+2Na2S2O3==2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴 作指示剂。
⑧用0.005 mol · L-1Na2S2O3滴定至终点。
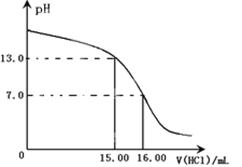
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如右图所示。
⑨经计算,此水样中氧(O2)的含量为(单位:mg·L-1) 。
⑩本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量的H2SO4使溶液呈 (填“酸性”、“碱性”或“接近中性”),其原因是 。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号