根据热化学方程S ( s ) + O2 ( g ) = SO2 ( g ) △H = -297.23 kJ/mol (反应在25℃,101kPa下发生)分析下列说法正确的是
| A.根据热化学方程式,燃烧1mol S放出的热量为297.23 kJ |
| B.形成1 mol SO2的化学键所释放的总能量大于断裂 1 mol S ( s )和 1mol O2 ( g )的化学键所吸收的总能量 |
| C.S ( g ) + O2 ( g ) = SO2 ( g )△H =-Q kJ/mol则Q>297.23 |
| D.S ( g ) + O2 ( g ) = SO2 ( g )△H =-Q kJ/mol则Q<297.23 |
 中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是

 N2(g)+2CO2(g) △H=-373.4kJ/mol
N2(g)+2CO2(g) △H=-373.4kJ/mol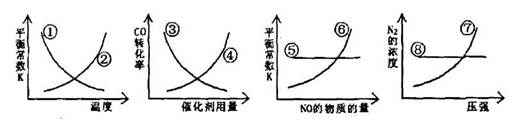
 粤公网安备 44130202000953号
粤公网安备 44130202000953号