(11分)氨在工农业生产中应用广泛。在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
| 温度/℃ |
200 |
300 |
400 |
500 |
600 |
| 氨含量/% |
89.9 |
71.0 |
47.0 |
26.4 |
13. 8 8 |
请回答:
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是_____________________________________________________________________________。
(2)根据表中数据,在500℃合成氨反应达到平衡时,与反应前的体积相比,反应后体积缩小的百分率是____________(保留2位有效数字)。
(3)在一定温度下,将2 mol N2和6 mol H2通入到体积为2 L的密闭容器中,发生反应
N2+3H2 2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。
2NH3,2 min达到平衡状态时,H2转化率是50%,该温度下的平衡常数K=______________(用分数表示);欲使K增大,可以采取的措施是___________________。
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是______(选填序号字母)
a.及时分离出NH3 b.升高温度c.增大压强 d.使用催化剂
(5)NH3也能分解为N2和H2,在相同条件下,测得分解后混合气体密度为分解前的2/3,则氨的分解率为_______。
(6)根据下图的能量变化,求下列反应的反应热。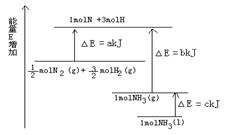
N2(g)+3H2(g) 2NH3(l) △H=___________。
2NH3(l) △H=___________。
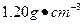 )配制100 mL 0.200
)配制100 mL 0.200 硫酸时,需用酸式滴定管量取24.5%硫酸_______ mL,洗净的酸式滴定管应先,再用来量取所需的硫酸。
硫酸时,需用酸式滴定管量取24.5%硫酸_______ mL,洗净的酸式滴定管应先,再用来量取所需的硫酸。 回答下列问题:
回答下列问题: 粤公网安备 44130202000953号
粤公网安备 44130202000953号