、能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)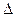 H1
H1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)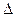 H2
H2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”);
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断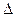 H1 0(填“>”“=”或“<”);
H1 0(填“>”“=”或“<”);
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.2mol·L-1,则CO的转化率为 .
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应Ⅰ进行甲醇合成,T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应 到某时刻测得各组分的浓度如下:
到某时刻测得各组分的浓度如下:
| 物质 |
H2 |
CO |
CH3OH |
| 浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
①比较此时正、逆反应速率的大小:v正 v逆(填“>”、“<”或“=”)。
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(3)生产过程中,合成气要进行循环,其目的是 。

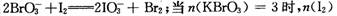 =mol,再向溶液中通入足量乙烯,充分反应后溶液增加的质量为g。
=mol,再向溶液中通入足量乙烯,充分反应后溶液增加的质量为g。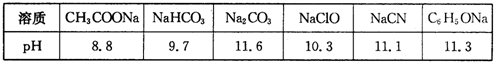
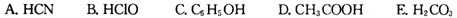
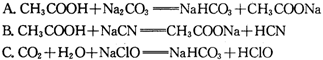
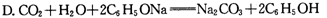
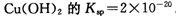 。又知常温下某CuSO4溶液里
。又知常温下某CuSO4溶液里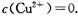
 是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
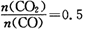 ,混合气体平均相对分子质量为。
,混合气体平均相对分子质量为。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号