T℃时,在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图I所示;若保持其他条件不变,温度分别为Tl和T2时,B的体积百分含量与时间的关系如图Ⅱ所示。则下列结论正确的是 ( )
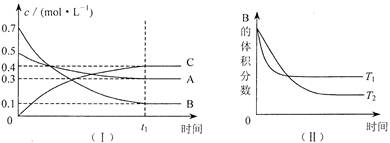
A.在达平衡后,保持其他条件不变,增大压强,平衡向正反应方向移动
B.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
C.保持其他条件不变,若反应开始时A、B、C的浓度分别为0.4mo1·L-1、0.5 mo1·L-1和0.2 mo1·L—1,则达到平衡后,C的浓度小于0.4 mo1·L-1
D.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大