(6分)可逆反应①X(g)+2Y(g) 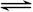 2Z(g) 、②2M(g)
2Z(g) 、②2M(g) 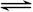 N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示: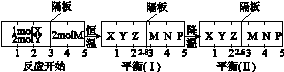
则X(g)+2Y(g) 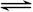 2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数
2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数
(6分)可逆反应①X(g)+2Y(g) 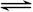 2Z(g) 、②2M(g)
2Z(g) 、②2M(g) 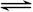 N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
则X(g)+2Y(g) 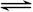 2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数
2Z(g)正反应为 反应(填“放热”或“吸热”)达到平衡(Ⅰ)时X的转化率为 (保留小数点后两位数字,下同);假设平衡(Ⅰ)时左边容器(X、Y、Z的体系)的体积为2L,求此温度下的化学平衡常数