(7分)(1)写出下图中序 号①~④仪器的名称:
号①~④仪器的名称: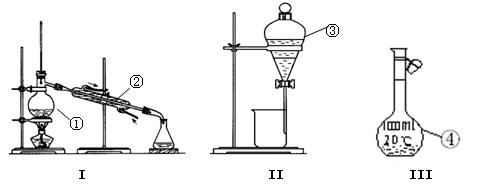
① ;② ; ③ ;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填仪器序号)
(3)分离碘水中的碘应选择装置II进行 和 操作(填操作名称)。
(7分)(1)写出下图中序 号①~④仪器的名称:
号①~④仪器的名称:
① ;② ; ③ ;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 。(填仪器序号)
(3)分离碘水中的碘应选择装置II进行 和 操作(填操作名称)。