(14分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答: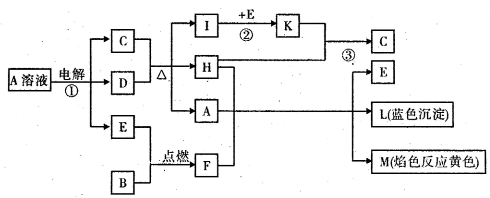
⑴写出化学式:A______ ; E______; L______
(2)反应①的离子方程式:________________________
⑶反应②,工业上釆取的反应条件是________________________
(4)反应③,工业上釆取的操作不是K直接与H反应,原因是__________________
(14分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
⑴写出化学式:A______ ; E______; L______
(2)反应①的离子方程式:________________________
⑶反应②,工业上釆取的反应条件是________________________
(4)反应③,工业上釆取的操作不是K直接与H反应,原因是__________________