化学家研究发现,在催化剂作用下,环氧丙烷(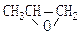 )可与某常见物质以1:1的物质的量之比反应,生成一种可降解的高聚物(
)可与某常见物质以1:1的物质的量之比反应,生成一种可降解的高聚物(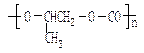 )。这个反应可充分利用参与反应的原料,实现零排放,符合绿色化学的要求,生成的高聚物可制造塑料制品。请回答下列问题:
)。这个反应可充分利用参与反应的原料,实现零排放,符合绿色化学的要求,生成的高聚物可制造塑料制品。请回答下列问题:
(1)与环氧丙烷反应的该常见物质是 。
(2)可降解高聚物的使用主要有助于缓解环境的 。(选填下列选项的编号字母)
| A.白色污染 | B.食品污染 | C.水污染 | D.气体污染 |
化学家研究发现,在催化剂作用下,环氧丙烷(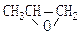 )可与某常见物质以1:1的物质的量之比反应,生成一种可降解的高聚物(
)可与某常见物质以1:1的物质的量之比反应,生成一种可降解的高聚物(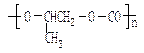 )。这个反应可充分利用参与反应的原料,实现零排放,符合绿色化学的要求,生成的高聚物可制造塑料制品。请回答下列问题:
)。这个反应可充分利用参与反应的原料,实现零排放,符合绿色化学的要求,生成的高聚物可制造塑料制品。请回答下列问题:
(1)与环氧丙烷反应的该常见物质是 。
(2)可降解高聚物的使用主要有助于缓解环境的 。(选填下列选项的编号字母)
| A.白色污染 | B.食品污染 | C.水污染 | D.气体污染 |