同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的( )
| A.2Na218O2 + 2H2O =" 4Nal8OH" + O2↑ |
| B.2KMnO4 + 5H218O2 + 3H2SO4 =" K2SO4" + 2MnSO4 + 518O2↑+ 8H2O |
C.NH4Cl + 2H2O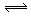 NH3·2H2O + HCl NH3·2H2O + HCl |
| D.K37ClO3 + 6HCl =" K37Cl" + 3Cl2↑+ 3H2O |
同位素示踪法可用于反应机理的研究,下列反应或转化中同位素示踪表示正确的( )
| A.2Na218O2 + 2H2O =" 4Nal8OH" + O2↑ |
| B.2KMnO4 + 5H218O2 + 3H2SO4 =" K2SO4" + 2MnSO4 + 518O2↑+ 8H2O |
C.NH4Cl + 2H2O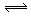 NH3·2H2O + HCl NH3·2H2O + HCl |
| D.K37ClO3 + 6HCl =" K37Cl" + 3Cl2↑+ 3H2O |