威斯迈尔反应是在富电子芳环上引入甲酰基的有效方法。其过程首先是N,N-二甲基甲酰胺与POCl3反应生成威斯迈尔试剂:
接着威斯迈尔试剂与富电子芳环反应,经水解后在芳环上引入甲酰基。例如: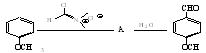
10-1用共振式表示威斯迈尔试剂正离子。
10-2由甲氧基苯转化为对甲氧基苯甲醛的过程中,需经历以下步骤:⑴芳香亲电取代 ⑵分子内亲核取代 ⑶亲核加成 ⑷质子转移 ⑸消除。画出所有中间体的结构简式。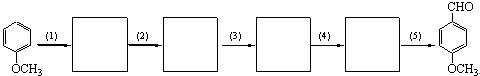
10-3完成下列反应: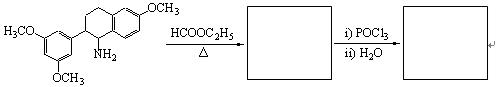
威斯迈尔反应是在富电子芳环上引入甲酰基的有效方法。其过程首先是N,N-二甲基甲酰胺与POCl3反应生成威斯迈尔试剂:
接着威斯迈尔试剂与富电子芳环反应,经水解后在芳环上引入甲酰基。例如: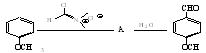
10-1用共振式表示威斯迈尔试剂正离子。
10-2由甲氧基苯转化为对甲氧基苯甲醛的过程中,需经历以下步骤:⑴芳香亲电取代 ⑵分子内亲核取代 ⑶亲核加成 ⑷质子转移 ⑸消除。画出所有中间体的结构简式。
10-3完成下列反应: