化合物B是以β-紫罗兰酮为起始原料制备维生素A的中间体。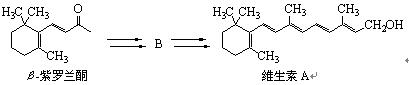
由β-紫罗兰酮生成B的过程如下所示: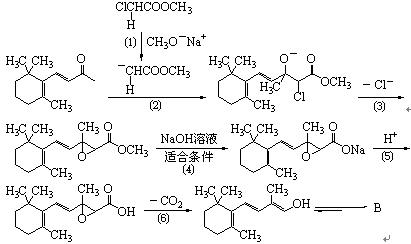
8-1 维生素A分子的不饱和度为 。
8-2 芳香化合物C是β-紫罗兰酮的同分异构体,C经催化氢解生成芳香化合物D,D的1H NMR图谱中只有一个单峰。画出C的结构简式。
8-3 画出中间体B的结构简式。
8-4 以上由β-紫罗兰酮合成中间体B的过程中,⑵、⑶、⑷、⑹步反应分别属于什么反应类型(反应类型表述须具体,例如取代反应必须指明是亲电取代、亲核取代还是自由基取代)。
化合物B是以β-紫罗兰酮为起始原料制备维生素A的中间体。
由β-紫罗兰酮生成B的过程如下所示:
8-1 维生素A分子的不饱和度为 。
8-2 芳香化合物C是β-紫罗兰酮的同分异构体,C经催化氢解生成芳香化合物D,D的1H NMR图谱中只有一个单峰。画出C的结构简式。
8-3 画出中间体B的结构简式。
8-4 以上由β-紫罗兰酮合成中间体B的过程中,⑵、⑶、⑷、⑹步反应分别属于什么反应类型(反应类型表述须具体,例如取代反应必须指明是亲电取代、亲核取代还是自由基取代)。