甲、乙、丙三种固体物质的溶解度曲线如下图所示。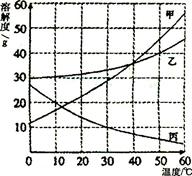
(1)30℃时,丙的溶解度是 。
(2) 5℃时,取甲、乙、丙三种固体物质各20g分别加入盛有lO0g水的烧杯中,充分搅拌后得到的溶液,能够饱和的是
物质的溶液。又将三个烧杯中的混合物温度都升高到30℃,所得溶液溶质质量分数的大小关系是
。
甲、乙、丙三种固体物质的溶解度曲线如下图所示。
(1)30℃时,丙的溶解度是 。
(2) 5℃时,取甲、乙、丙三种固体物质各20g分别加入盛有lO0g水的烧杯中,充分搅拌后得到的溶液,能够饱和的是
物质的溶液。又将三个烧杯中的混合物温度都升高到30℃,所得溶液溶质质量分数的大小关系是
。