2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图: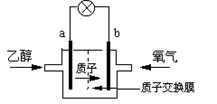
(1)_________极(填a或b)为电池的负极,电池工作时电流方向为______________;
(2)写出电池正极反应方程式___________________;
(3)电池工作时,1mol乙醇被氧化时就有________mol电子转移。
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图:
(1)_________极(填a或b)为电池的负极,电池工作时电流方向为______________;
(2)写出电池正极反应方程式___________________;
(3)电池工作时,1mol乙醇被氧化时就有________mol电子转移。