惕各酸的分子式为C5H8O2,且含有两个甲基,它是生产某种香精的中间体。为了合成该物质,某实验室的科技人员设计了下列合成路线: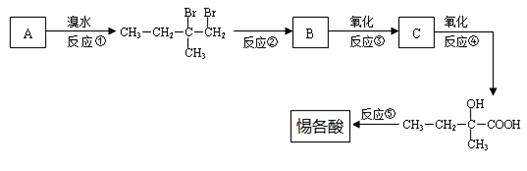
回答下列问题:
(1)A的结构简 式为 。
式为 。
(2)反应②的化学方程式为  。
。
(3)反应⑤的化学方程式为 。
(4)上述合成路线 中属于取代反应的是 (填编号)。
中属于取代反应的是 (填编号)。
惕各酸的分子式为C5H8O2,且含有两个甲基,它是生产某种香精的中间体。为了合成该物质,某实验室的科技人员设计了下列合成路线:
回答下列问题:
(1)A的结构简 式为 。
式为 。
(2)反应②的化学方程式为  。
。
(3)反应⑤的化学方程式为 。
(4)上述合成路线 中属于取代反应的是 (填编号)。
中属于取代反应的是 (填编号)。