乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明是: 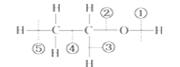
A.和金属钠反应时断裂 键 B .在铜催化共热下与O2反应时断裂 键
.在铜催化共热下与O2反应时断裂 键
C.在消去反应时断裂 键 D.在 酯化反应时断裂 键
乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说明是: 
A.和金属钠反应时断裂 键 B .在铜催化共热下与O2反应时断裂 键
.在铜催化共热下与O2反应时断裂 键
C.在消去反应时断裂 键 D.在 酯化反应时断裂 键