在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③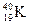 和
和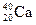
④
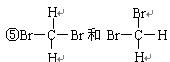 ⑥甲烷与丙烷
⑥甲烷与丙烷
⑦乙醇(CH3CH2OH)和乙二醇(HO—CH2—CH2—OH)
(1)互为同位素的是  ;
;
(2)互为同分异构体的是 ;
(3)互为同系物的是 ;
(4)同一种物质的是 。
在下列各组物质中,找出合适的序号填在对应的空格内:
①NO2和N2O4 ②12C和14C ③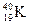 和
和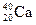
④
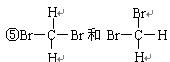 ⑥甲烷与丙烷
⑥甲烷与丙烷
⑦乙醇(CH3CH2OH)和乙二醇(HO—CH2—CH2—OH)
(1)互为同位素的是  ;
;
(2)互为同分异构体的是 ;
(3)互为同系物的是 ;
(4)同一种物质的是 。