下表为元素周期表短周期的一部分请回答下列问题: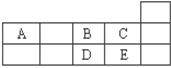
(1)A与B形成的阴离子可能有----------------------------------。(填化学式)
(2)五种元素形成的气态氢化物中 最稳定。(填化学式)
(3)写出D的氢化物在过量的B中燃烧的化学方程式___________________________。
(4)写出由A、B两种元素形成的非极性分子的电子式 。A、E两元素形成化合物的空间构型为_____________。
下表为元素周期表短周期的一部分请回答下列问题:
(1)A与B形成的阴离子可能有----------------------------------。(填化学式)
(2)五种元素形成的气态氢化物中 最稳定。(填化学式)
(3)写出D的氢化物在过量的B中燃烧的化学方程式___________________________。
(4)写出由A、B两种元素形成的非极性分子的电子式 。A、E两元素形成化合物的空间构型为_____________。