( 6分) A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。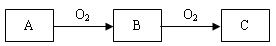
(1)若A是一种黄色单质固体,则A的分子式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 ,试用化学方程式表示该物质的一个重要应用 。
(3)若C是红棕色气体,则A的化学式可能为 。
( 6分) A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
(1)若A是一种黄色单质固体,则A的分子式为 。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为 ,试用化学方程式表示该物质的一个重要应用 。
(3)若C是红棕色气体,则A的化学式可能为 。