如图甲乙丙三个烧杯依次分别盛放氢氧化钠溶液、硫酸铜溶液、硫酸钾溶液,电极均为石墨电极,通电一段时间,乙中c电极质量增加64克,据此回答问题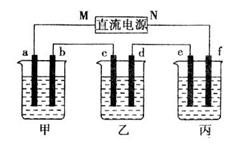
①电源的N端为 ___________极
②电极b上发生的电极反应为__________________________________
③电极b上生成的气体在标准状况下的体积______________________升
④电极e上生成的气体在标准状况下的体积_______________________升
如图甲乙丙三个烧杯依次分别盛放氢氧化钠溶液、硫酸铜溶液、硫酸钾溶液,电极均为石墨电极,通电一段时间,乙中c电极质量增加64克,据此回答问题
①电源的N端为 ___________极
②电极b上发生的电极反应为__________________________________
③电极b上生成的气体在标准状况下的体积______________________升
④电极e上生成的气体在标准状况下的体积_______________________升