KMnO4是常见的试剂。
Ⅰ.某小组拟用酸性KMnO4溶液与H2C2O4(K1=5.4×10-2)的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量
编号
|
V(0.20 mol/LH2C2O4溶液)/mL
|
甲
|
V(0.010mol/L KMnO4溶液)/mL
|
M(MnSO4固体)/g
|
T/℃
|
乙
|
①
|
2.0
|
0
|
4.0
|
0
|
50
|
|
②
|
2.0
|
0
|
4.0
|
0
|
25
|
|
③
|
1.0
|
a
|
4.0
|
0
|
25
|
|
④
|
2.0
|
0
|
4.0
|
0.1
|
25
|
|
回答下列问题:
(1)完成上述反应原理的离子反应方程式
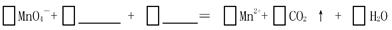
(2)上述实验①②是探究对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写,a为;乙是实验需要测量的物理量,则表格中“乙”应填写。
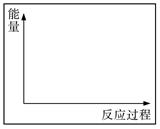
(3)上述实验②④是探究催化剂对化学反应速率的影响。
请在答题卷的坐标图中画出实验②和④的能量变化关系图(作必要的标注)。
Ⅱ.某化学小组利用下图装置进行实验证明氧化性:KMnO4>Cl2>Br2。限选试剂:KBr溶液、KMnO4、浓盐酸、浓硫酸

(4)装置a、d中盛放的试剂分别是:、;实验中观察到的现象为;此实验装置的不足之处是。