其他条件不变的情况下,下列说法不正确的是:
A. 对于反应nA(g)+B(g)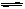 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
B. 对于反应2A(g)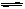 B(g) △H<0,若体系温度不再变化说明反应达到平衡状态。
B(g) △H<0,若体系温度不再变化说明反应达到平衡状态。
C. 对于反应2A(g)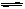 B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
D. 对于反应2A(g)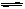 B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
其他条件不变的情况下,下列说法不正确的是:
A. 对于反应nA(g)+B(g)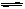 2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
2C(g),平衡后增大压强,A的百分含量减小,则n≥2。
B. 对于反应2A(g)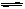 B(g) △H<0,若体系温度不再变化说明反应达到平衡状态。
B(g) △H<0,若体系温度不再变化说明反应达到平衡状态。
C. 对于反应2A(g)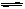 B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
B(g),恒温、恒容条件下气体密度不再变化说明反应达到平衡状态。
D. 对于反应2A(g)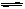 B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。
B(g),若ν(A)正=2ν(B)逆,说明反应达到平衡状态。