(8分)
(1)表示含有20个中子的氯原子的符号为
(2)写出4核10电子分子的电子式
(3)已知一氧化碳的燃烧热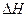 为—283kJ/mol,写出表示一氧化碳燃烧热的热化学方程式
为—283kJ/mol,写出表示一氧化碳燃烧热的热化学方程式
(4)CH3OH与 O2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是 。
O2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是 。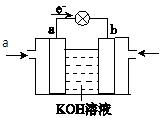
(8分)
(1)表示含有20个中子的氯原子的符号为
(2)写出4核10电子分子的电子式
(3)已知一氧化碳的燃烧热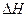 为—283kJ/mol,写出表示一氧化碳燃烧热的热化学方程式
为—283kJ/mol,写出表示一氧化碳燃烧热的热化学方程式
(4)CH3OH与 O2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是 。
O2的反应可将化学能转化为电能,其工作原理如图所示,a极的电极反应式是 。