一个国家乙烯工业的发展水平,已成为衡量该国石油化学工业水平的重要标志之一。以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。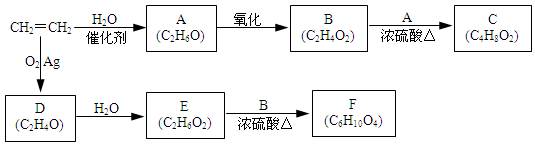
已知:①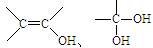 结构非常不稳定,会迅速转变为
结构非常不稳定,会迅速转变为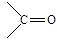
②三元环状化合物易发生开环加成,例如:
请回答下列问题:
(1)A的化学名称是_______。
(2)B和A反应生成C的化学方程式为___________。
(3)D的结构简式为___________。
(4)F的结构简式为_____________。
(5)D的同分异构体的结构简式为___________。
一个国家乙烯工业的发展水平,已成为衡量该国石油化学工业水平的重要标志之一。以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去)。
已知:①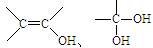 结构非常不稳定,会迅速转变为
结构非常不稳定,会迅速转变为
②三元环状化合物易发生开环加成,例如:
请回答下列问题:
(1)A的化学名称是_______。
(2)B和A反应生成C的化学方程式为___________。
(3)D的结构简式为___________。
(4)F的结构简式为_____________。
(5)D的同分异构体的结构简式为___________。