2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。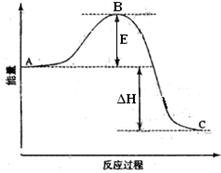
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示 、 ,
(2)图中△H= KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,
计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。
已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
(1)图中A、C分别表示 、 ,
(2)图中△H= KJ·mol-1;
(3)已知单质硫的燃烧热为296 KJ·mol-1,
计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。