已知:I2+2 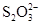 ===
=== 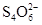 +2I-。相关物质的溶度积常数见下表:
+2I-。相关物质的溶度积常数见下表:
物质
|
Cu(OH)2
|
Fe(OH)3
|
CuCl
|
CuI
|
Ksp
|
2.2×10-20
|
2.6×10-39
|
1.7×10-7
|
1.3×10-12
|
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是__________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是__________________________________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为___________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
 钠小球在水面四处游动,并发出“嘶嘶”声
钠小球在水面四处游动,并发出“嘶嘶”声  钠小球在水面四处游动,并发出“嘶嘶”声
钠小球在水面四处游动,并发出“嘶嘶”声