脱水环化是合成生物碱类天然产物的重要步骤,某生物碱合成路线如图:
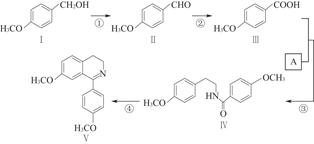
(1)化合物Ⅱ的化学式为。
(2)反应①的化学方程式为(不要求写出反应条件)。
(3)化合物A的结构简式为。
(4)下列说法正确的是。
| A.化合物Ⅱ能发生银镜反应 |
| B.化合物Ⅰ~Ⅴ均属于芳香烃 |
| C.反应③属于酯化反应 |
| D.化合物Ⅱ能与4 mol H2发生加成反应 |
E.化合物Ⅰ、Ⅱ、Ⅲ均能与金属钠反应放出氢气
(5)化合物Ⅵ与化合物Ⅲ互为同分异构体,Ⅵ中含有酯基,且能与FeCl3溶液发生显色反应,其苯环上的一氯代物只有2种。写出一种满足上述条件的Ⅵ的结构简式:。
(6)化合物Ⅶ(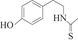 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为。