汽车尾气净化中的一个反应如下:
 2NO(g)+2CO(g)
2NO(g)+2CO(g) N2(g)+2CO2(g)△H=-746.8kJ·mol-1
N2(g)+2CO2(g)△H=-746.8kJ·mol-1 ,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是
,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是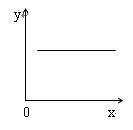
| A.当X表示温度时,Y表示平衡常数K |
| B.当X表示温度时,Y表示CO的转化率 |
| C.当X表示N2的物质的量时,Y表示NO的转化率 |
| D.当X表示NO的物质的量时,Y表示平衡常数K |
汽车尾气净化中的一个反应如下:
 2NO(g)+2CO(g)
2NO(g)+2CO(g) N2(g)+2CO2(g)△H=-746.8kJ·mol-1
N2(g)+2CO2(g)△H=-746.8kJ·mol-1 ,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是
,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是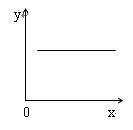
| A.当X表示温度时,Y表示平衡常数K |
| B.当X表示温度时,Y表示CO的转化率 |
| C.当X表示N2的物质的量时,Y表示NO的转化率 |
| D.当X表示NO的物质的量时,Y表示平衡常数K |