聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
AlT/(mol·L-1)
|
Ala/%
|
Alb/%
|
A1c/%
|
0.208
|
1.4
|
86.6
|
12.0
|
0.489
|
2.3
|
86.2
|
11.5
|
0.884
|
2.3
|
88.1
|
9.6
|
1.613
|
3.1
|
87.0
|
9.9
|
2.520
|
4.5
|
88.2
|
7.3
|
①在一定温度下,AlT越大,pH(填“越大”、“越小”或“不变”)。
②如将AlT =" 2.520" mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式:。
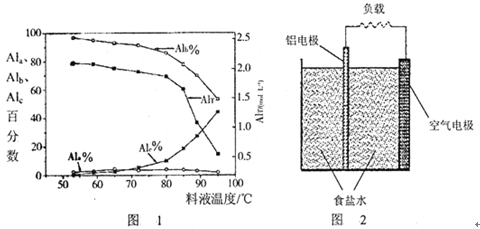
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图1。当T>80℃时,AlT显著下降的原因是。
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g)△H1 =" a" kJ·mol-1
②3AlCl(g) =" 2Al(l)+" AlCl3(g)△H2 =" b" kJ·mol-1
则反应Al2O3(s)+ 3C(s) =" 2Al(l)+" +3CO(g)△H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图2所示,写出该电池正极的电极反应式。

