某待测液中(所含阳离子为Na+) 可能含有SO42-、SO32-、Cl-、Br-、
|
NO3-、CO32-、HCO3-中的一种或几种,进行下列实验(每次实验所加试剂均足量)。回答以下问题:
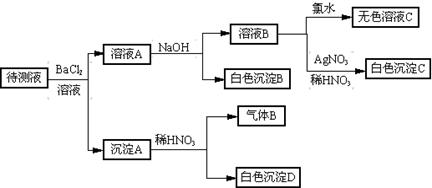
⑴待测液中是否含有SO42-、SO32-__________。
⑵沉淀B的化学式____
 。
。⑶根据以上实验,待测液中肯定没有的离子是___________;肯定还存在的阴离子是______。
某待测液中(所含阳离子为Na+) 可能含有SO42-、SO32-、Cl-、Br-、
|
NO3-、CO32-、HCO3-中的一种或几种,进行下列实验(每次实验所加试剂均足量)。回答以下问题:

 。
。