将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g) 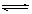 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是
A.A、B的转化率均为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol
将0.6 mol A和0.5 mol B充入0.4L密闭容器中发生2A(g)+B(g) 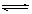 mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是
mD(g)+E(g),经过5min后达到化学平衡,此时测得D为0.2 mol。又知5min内用E表示的平均反应速率为0.1 mol·L-1·min-1,下列结论正确的是
A.A、B的转化率均为20%
B.m值为1
C.5min内用A表示的平均反应速率为0.1 mol·L-1·min-1
D.平衡时混合物总物质的量为1 mol