有下列各组物质: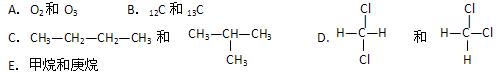
(1)_________组两物质互为同位素;(2)__________组两物质互为同素异形体;
(3)_________组两物质属于同系物;(4)_________组两物质互为同分异构体;
(5)_________组中两物质是同一物质。
有下列各组物质: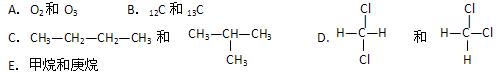
(1)_________组两物质互为同位素;(2)__________组两物质互为同素异形体;
(3)_________组两物质属于同系物;(4)_________组两物质互为同分异构体;
(5)_________组中两物质是同一物质。